М. Я. Савельева, О. Г. Усьяров
(Агрофизический научно-исследовательский институт ВАСХНИЛ им. В. И. Ленина, Ленинград)
При исследовании устойчивости смачивающих пленок растворов цетилтриметиламмонийбромида (ЦТАБ) было обнаружено явление самопроизвольного перехода от толстых {5-плеиок к тонким а-пленкам [540]. Такой переход был объяснен нали
чием двух минимумов на зависимости энергии несимметричного тонкого жидкого слоя от его толщины. ЦТАБ, будучи ионоген — ным поверхностно-активным веществом (ПАВ), способен в значительной степени изменять заряды граничных поверхностей, определяя ионно-электростатическую компоненту расклинивающего давления [42]. При этом вследствие того, что на межфазных границах происходит предпочтительная специфическая ад — сорбия катионов (в принципе, различная для границ жидкость— газ и твердое тело — жидкость), в смачивающих пленках может осуществляться перекрытие как одноименно, так и разноименно заряженных двойных ионных слоев при варьировании содержания поверхностно-активных молекул в дисперсионной среде.
В дальнейшем [541] самопроизвольное а—^-превращение было обнаружено нами при исследовании растворов ПАВ неионного типа: гомологического ряда алкилоламидов жирных кислот с числом углеводородных атомов от 9 до 11. Как оказалось, динамическое равновесие между а — и [}- пленками существенно зависит от концентрации ПАВ в системе. Априори можно полагать, что при добавлении к воде алкилоламидов жирных кислот заметно изменялась молекулярная составляющая расклинивающего давления. В предварительно проведенных опытах [541] была установлена специфичность поведения ПАВ с различной длиной углеводородной цепи. В связи с возможным влиянием ПАВ на свойства двойных ионных слоев [542] представляло интерес изучить корреляцию поверхностной активности молекул гомологического ряда ПАВ с электрокинетическими характеристиками двойных слоев для границ жидкость — газ и твердое тело — жидкость, с одной стороны, и с устойчивостью смачивающих пленок, полученных из растворов алкилоламидов жирных кислот, — с другой.
Изучали устойчивость смачивающих пленок на внутренних стенках цилиндрических стеклянных капилляров; пленки формировали путем введения в капилляр, заполненный исследуемым раствором, маленького пузырька воздуха [543]. Длина цилиндрической части тонких жидких слоев во всех опытах составляла 0,20+0,01 см. Капилляры диаметром 0,032±0,003 см изготавливали из стекла марки «Пирекс». Тщательный контроль длины и радиуса пленок необходим в связи с сильной зависимостью их устойчивости от геометрических размеров [544, 545]. После заполнения раствором и введения пузырька воздуха капилляры помещали в атмосферу насыщенного водяного пара для предотвращения испарения из них воды и периодически рассматривали смачивающие пленки под микроскопом. Прорыв тонких слоев сопровождался либо распадом их на мелкие капли размером порядка десятков микрометров, либо прорывом пленки вблизи менисков и наступающего вследствие этого оттока жидкости от зоны прорыва. Для получения статистически достоверных результатов для каждой системы формировали и наблюдали 80—100 пленок.
На основании результатов наблюдения строили временную зависимость вероятности прорыва тонких слоев, рассчитываемую как отношение числа установленных случаев прорыва к общему числу исходных пленок. Объектами исследования были пленки водных растворов алкилоламидов жирных кислот: унде- циловой, лауриновой и тридекановой с концентрацией от Ю-7 до 10~3 моль/дм3 при варьируемой концентрации NaCl и варьируемом рН системы. Поверхностно-активные вещества перед проведением опытов тщательно очищали путем многократного переосаждения[6].
Поверхностное натяжение растворов как функцию их состава измеряли методом максимального давления пузырька по известной методике. Электропроводность дисперсионной среды определяли, используя мост переменного тока; погрешность, не превышала 10%. Измерение электрокинетического потенциала для границ жидкость—газ и стекло—жидкость выполняли методом микроэлектрофореза в плоскопараллельной кювете. Предварительно исследуемое стекло измельчали в шаровой мельнице с металлическими шарами в течение нескольких часов. Образующуюся дисперсную систему многократно отмывали на фильтре 1 н. раствором НС1 от примесей железа, а затем — от хлорид — ионов (контроль — реакция с AgN03). Отделенный от дисперсионной среды, отмытый осадок высушивали в термостате при 105 °С.
Суспензии для электрофоретических измерений готовили, диспергируя 1 г твердой фазы в 100 мл дисперсионной среды. Дисперсии выдерживали, как правило, в течение месяца для установления равновесия в закрытых сосудах, периодически встряхивая. Для исследования обычно отбирали мелкодисперсную фракцию частиц из верхней части сосуда после непродолжительного отстаивания суспензии и помещали эту сравнительно разбавленную систему в измерительную камеру прибора для микроэлектрофореза. Диаметр частиц дисперсной фазы составлял приблизительно 0,1 мкм.
Дисперсии пузырьков воздуха в растворах ПАВ создавали следующим образом. Исследуемый раствор сохраняли несколько дней в холодильнике, выдерживая при температуре около 0 °С в закрытой емкости. Затем через жидкость с помощью насоса барботировали пузырьки воздуха в течение нескольких минут для насыщения ее растворенным газом и переносили со-
Рис. 12.1. Схема установки для измерения электрокинетического потенциала частиц методом микроэлектрофореза:
|
7- Z . 6- |
|
7 " —Z |
1 — измерительная кювета; 2— боковые емкости; 3 — основание; 4 — темнопольный объектив; 5 — гель агар-агара; 6 — раствор CuS04; 7 — медные электроды
Уз
Суд в ультразвуковое поле. Ультразвук вызывал, с одной стороны, нагревание раствора, т. е. переход его в состояние пересыщения по газу, а с другой, — возникновение под действием кавитации микрозародышей газовой фазы — мелких пузырьков воздуха размером порядка нескольких сотых долей микрометра. Образующиеся пены были сравнительно устойчивы: заметного укрупнения и всплывания пузырьков не наблюдали в течение нескольких часов, необходимых для проведения измерений. Так как концентрация пен была сравнительно велика, их разбавляли приблизительно в 10 раз дисперсионной средой, доводя содержание микрообъектов до «1-Ю9 1/см3.
Измерение скорости электрофореза выполняли в специально сконструированной кювете, схема которой дана на рис. 12.1. Рабочую стеклянную кювету 1 в виде прямоугольного парал — лепипеда с открытыми торцами длиной 20 мм и поперечным сечением 20X0,8мм помещали между двумя сосудами 2 также прямоугольного сечения, изготовленными из оргстекла. Толщина стенок измерительной ячейки составляла 0,2 мм, что обеспечивало надежную визуализацию микрообъектов при работе с темнопольным микроскопом. Боковые емкости 2 в месте их сочленения с кюветой имели ряд отверстий диаметром 0,5 мм; эти емкости прочно закреплялись на основании 3, в котором было высверлено отверстие для вхождения темнопольного объектива 4. В нижнюю часть емкостей 2 помещали гель агар-агара 5, приготовленный на 1 н. растворе КС1; сверху заливали 0,1 н. раствор CuS04 (6) и помещали медные электроды 7. Такая установка удобна в обращении; в ней обеспечена герметичность сочленения боковых емкостей с измерительной камерой и возможность тщательной очистки последней после проведения исследований. На основании данных о подвижности частиц дисперсной фазы вычисляли ^-потенциал по формуле Гельмголь — ца — Смолуховского без учета поправки на поверхностную проводимость [59].
Пленки дистиллированной воды на поверхности стеклянных капилляров обладали высокой устойчивостью. Их прорыв не обнаруживался в течение длительного времени наблюдения, что подтверждает ранее полученные результаты [546] о стабильности тонких жидких слоев на поверхности стекла в опре
деленном интервале расклинивающих давлений и длин пузырьков. Небольшие добавки ПАВ обусловливают резкое снижение устойчивости. В качестве примера на рис. 12.2 представлены зависимости вероятности прорыва пленок от времени Р (/) для растворов алкилоламида ундедиловой кислоты при четырех различных концентрациях ПАВ. Следует отметить, что при содержании ПАВ около 1-Ю-5 моль/дм3 тонкие жидкие слои практически мгновенно распадались на отдельные капли. Аналогичные закономерности были установлены и для других ал — килоламидов жирных кислот.
Для всех функций P(T) проявляется одна и та же особенность: они имеют «плато» при больших временах наблюдения. Это плато характеризует динамическое равновесие в системе, при котором происходит самопроизвольный переход от толстых р-пленок к тонким а-пленкам и наоборот. К сожалению, частоту таких переходов измерить не удалось, поскольку они осуществляются крайне редко и не для всех рассматриваемых пленок. На основании наблюдений можно лишь утверждать, что период прямого и обратного переходов составляет не менее 2—3 ч. Несмотря на подобный характер зависимостей P(t) для изученного ряда ПАВ, они имели некоторые различия, заключающиеся, главным образом, в уровне плато Pf как функции концентрации алкилоламидов жирных кислот (рис. 12.3). Максимумы соответствующих кривых Pf (С) не коррелировали с длиной уг-
|
Р(Ь) ‘ Pf
Рис. 12.2. Зависимость вероятности прорыва смачивающих пленок в присутствии алкилоламида ундециловой кислоты от времени при различном содержании ПАВ: / — I 10—®; 2-Ю-4; 3-5-10-4; 4- 1 ■ 10—3 моль/дм3 0 К T — Ю’2,Ч- |
|
8 |
|
|
|
J |
Рис. 12.3. Зависимость значений Pf, отвечающих предельным вероятностям прорыва пленок, от концентрации алкилоламидов кислот:
1 — ундециловой; 2 — лауриновой; 3 — тридекановой
|
|
|
О |
|
62 |
|
О 0,2 0,4 0,6 0,8 1,0 С — Ю3 моль /дм3 |
|
Рис. 12.4. Изотерма поверхностного натяжения для алкилоламидов кислот: 1 — ундедиловой; 2— лаурнновой; 3 — тридекановой |
|
И Ч «а" |
|
О |
|
|
Рис. 12.5. Зависимость электрокинетического потенциала частиц стекла (1) и пузырьков воздуха (2) от концентрации алкилоламида ундециловой кислоты
Леводородного радикала. Так, для алкилоламида ундециловой кислоты при ее содержании от 5-Ю-6 до Ю-5 моль/дм3 пленки либо обладали очень низкой устойчивостью и прорывались в течение нескольких минут, либо вообще не образовывались. Следующий гомолог—алкилоламид лауриновой кислоты — обусловливал сравнительно низкий уровень плато Pf. Алкилоламид тридекановой кислоты по своему действию на устойчивость тонких жидких слоев занимал промежуточное положение.
Поверхностная активность исследованных ПАВ, характеризуемая зависимостью поверхностного натяжения растворов от концентрации (рис. 12.4), находилась в соответствии с их дестабилизирующим влиянием на пленки. Сопоставление рис. 12.3 и 12.4 позволяет сделать вывод, что существует корреляция между поверхностной активностью и, следовательно, адсорбцией ПАВ на границах раздела и устойчивостью пленок. При предельном содержании ПАВ яМО-3 моль/дм3, как показывают расчеты, во всех случаях практически достигается образование плотного мономолекулярного слоя на границе жидкость— газ, причем площадь, занимаемая одной молекулой, составляет «2-Ю-15 см2 [547].
Поскольку в работе использовали неионогенные ПАВ и соответствующие растворы при повышении концентрации в пределах погрешности измерений не обнаруживали роста электропроводности, можно было ожидать, что они не будут оказывать заметного влияния на электрокинетический потенциал границ раздела
жидкость —газ и твердое тело — жидкость. Однако при изучении микроэлектрофореза пузырьков воздуха и частиц стекла было установлено значительное, немонотонное изменение ^-потенциала при добавлении к дисперсионной среде алкилоламидов. В качестве примера эти результаты представлены на рис. 12.5 для алкилоламида ундециловой кислоты. Аналогичный характер зависимостей обнаружен и для других исследованных соединений. При сравнительно низком содержании алкилоламида ундециловой кислоты С<10-7 моль/дм3 электрокинетические потенциалы для обеих границ раздела фаз не отличались от соответствующих значений для дистиллированной воды. При С>10~7 моль/дм3 как для поверхности жидкость — газ, так и для частиц стекла абсолютные значения ^-потенциала возрастали, достигая максимума при С= 10-5-т-10~4 моль/дм3, а затем вновь уменьшались по мере роста концентрации ПАВ. Значения электрокинетического потенциала были относительно большими — в максимуме около—150 мВ. Это, в принципе, требует введения поправки на поверхностную проводимость [59], что особенно существенно для рассматриваемых случаев разбавленных растворов электролитов при 1, где 1 /к —
Дебаевский радиус экранирования, а — радиус микрообъектов. Однако ввиду постоянства ионной силы раствора для всех точек кривых 1 и 2 (рис. 12.5) учет поверхностной проводимости качественно не изменит картины и, кроме того, такой учет может быть проведен лишь — приблизительно вследствие неопределенности формы и размера микрообъектов.
Сопоставляя рис. 12.3 (кривая 1) и рис. 12.5, можно отметить, что максимум неустойчивости р-пленок приходится на тот интервал концентраций ПАВ, в котором обнаруживались наиболее высокие значения электрокинетических потенциалов. Такое антибатное изменение потенциалов поверхности границ жидкость — газ и жидкость—. твердое тело, с одной стороны, и стабильности жидких слоев, — с другой, позволяет предполагать сильное влияние адсорбции ПАВ на молекулярную составляющую расклинивающего давления.
Устойчивость смачивающих пленок в значительной степени определялась не только содержанием ПАВ, но и величиной рН раствора. Это иллюстрирует рис. 12.6, на котором приведены экспериментальные данные, относящиеся к уровню плато Pf При постоянной концентрации ПАВ в системе и варьируемой величине рН (кривая 1), а также зависимости Pf(C) при двух различных рН (кривые 2 и 3). Следует отметить, что кривая 1 отвечает переменной ионной силе раствора, а кривые 2 и 3 — постоянной. В области рН<3 смачивающие пленки являются абсолютно неустойчивыми (кривая 1). Однако этот вывод справедлив лишь для некоторой области концентраций раствора ПАВ (кривая 2). При щелочных рН устойчивость пленок хотя
|
Рис. 12.6. Зависимость значений Pf от рН при переменной ионной силе раствора (/): Концентрация алкилоламида ундециловой кислоты 10-3 моль/дм3; рН=2,75 (2); 11,2 (3) |
Рис. 12.7. Зависимость ^-потенциала частиц стекла (/, 2) и пузырьков воздуха (5, 4) от концентрации алкилоламида ундециловой кислоты при различных рН раствора:
1, 3 —при рН=2,75; 2, 4 — при рН = 11,2
И несколько выше, чем при кислых, но также зависит от содержания алкилоламидов в системе: при С=10-4 моль/дм3 наблюдается прорыв практически всех (ї-пленок, когда рН=11,2.
При рассмотрении данных об электрокинетическом потенциале частиц стекла и пузырьков воздуха как функции рН при различных концентрациях ПАВ не обнаруживается непосредственной корреляции между стабильностью сравнительно толстых жидких слоев и ^-потенциалом. Так, во всем интервале концентраций алкилоламида ундециловой кислоты и рН = 2,75 границы раздела раствор — газ и раствор — стекло были противоположно заряжены (рис. 12.7, кривые 1, 3). Исходя из этого, следовало ожидать отсутствия стабильности fi-пленок при любом содержании ПАВ, что не наблюдается в опыте (рис. 12.6, кривая 2). Наоборот, ^-потенциалы частиц стекла и пузырьков воздуха при рН = 11,2 имеют одинаковый знак и сравнительно велики, но, правда, снижаются по мере роста значений С (рис. 12.7, кривые 2,4). Однако максимум устойчивости (ї-пленок соответствует в этом случае наибольшей из исследованных концентраций ПАВ и, следовательно, минимуму электрокинетического потенциала.
В то время как при варьировании рН и содержания ПАВ в пленках, на первый взгляд, не прослеживается взаимосвязь электроповерхностных свойств и устойчивости, влияние концентрации п электролита проявлялось более определенно (рис. 12.8). При повышении содержания NaCl в растворе от 10~6 до Ю-4 моль/дм3 электрокинетические потенциалы частиц стекла и пузырьков воздуха слабо уменьшались; их сильное снижение наступало при я>Ы0~3 моль/дм3. В концентрированных растворах электролита (я = 0,1 моль/дм3) значение ^-потенциалов для обеих границ составляет несколько милливольт.
В соответствии с изменением ^-потенциалов происходило изменение устойчивости р-пленок, характеризуемой уровнем плато Pf. В разбавленных растворах электролита смачивающие пленки более или менее сохраняли стабильность, свойственную растворам ПАВ (см. рис. 12.8, кривая 1). В области концентраций, отвечающих значительному уменьшению £-потен — циалов частиц стекла и пузырьков воздуха, проявлялось резкое снижение устойчивости, которая при я=0,1 моль/дм3 практически отсутствовала. Результаты, аналогичные приведенным на рис. 12.8, получены нами также для других значений С и для других соединений изученного гомологического ряда.
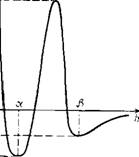
Переходя к обсуждению полученных экспериментальных данных, отметим, что существование динамического равновесия между ос — и р-пленками позволяет сделать однозначный вывод о наличии двух энергетических минимумов на зависимости энергии тонкого жидкого слоя от его толщины (рис. 12.9). Впервые
|
|
|
|
|
О |
|
TfymLn |
Pj-^J — е Л, я ищ—————————————-
|
|
Рис. 12.8. Зависимость значений Pf (1), а также ^-потенциала частиц стекла (2) и пузырьков воздуха (3) от содержания NaCl в растворе.
Концентрация алкилоламида ундециловой кислоты 1-Ю-3 моль/дм®
Рис. 12.9. Зависимость энергии пленки от ее толщины
Это предположение было высказано ранее [548] при исследовании устойчивости пленок электролитов в капиллярах различного радиуса и подтверждено экспериментально в работах [540, 541]. Соотношение минимумов, очевидно, определяет уровень плато Pf на кривых, характеризующих вероятность прорыва В ЗаВИСИМОСТИ ОТ Времени. В ТОМ Случае КОГДа t/| min>t/2mln, в выборке при і—>-оо преобладают а-пленки; при обратном неравенстве—fS-пленки. Тот факт, что взаимные аз^р-переходы пленок обнаруживаются не для всех объектов в исследуемой выбора, может быть объяснен как вариацией поверхностных свойств использованных в работе капилляров, их геометрических размеров и формы, так и малой частотой таких переходов, обусловленной сравнительно высокими энергетическими барьерами, разделяющими оба квазиравновесных состояния системы.
Высота энергетического барьера (см. рис. 12.9), с одной стороны, определяет кинетику установления равновесия между двумя возможными состояниями системы, а с другой, — частоту переходов между а — и р-пленками. По-видимому, в большинстве изученных нами случаев высота энергетического барьера была достаточно велика, за исключением тех систем, в которых толстые смачивающие слои жидкости прорывались практически мгновенно.
Временная эволюция системы (рис. 12.2), в принципе, может быть рассмотрена как однородной марковский процесс с непрерывным временем t [549]. Из соответствующих уравнений могут быть получены оценки для вероятностей взаимного перехода а — и р-пленок на основании вида функции P(T). Такой подход является целесообразным для количественной характеристики устойчивости. Однако для того чтобы найденные оценки можно было сопоставить с высотами энергетического барьера и глубиной минимумов, необходима теория прорыва смачивающих пленок, которая в настоящее время еще не развита в достаточной степени [45].
Наибольший интерес в связи с обнаруженными зависимостями устойчивости смачивающих пленок в присутствии ПАВ вызывают два обстоятельства. Во-первых, необходимо обсудить возможное влияние адсорбции ПАВ, определяемой их поверхностной активностью, на молекулярную составляющую расклинивающего давления и, следовательно, на глубину минимумов Ui шіп и U2 tnin! во-вторых, нужно проследить корреляцию между ^-потенциалом границ жидкость — газ и стекло — жидкость и стабильностью толстых жидких слоев.
Тот факт, что уже сравнительно малые добавки ПАВ резко снижают устойчивость смачивающих пленок, но при этом практически не сказываются на электрокинетическом потенциале границ раздела фаз (рис. 12.3 и 12,5), приводит к заключению о значительном изменении молекулярной составляющей рас-
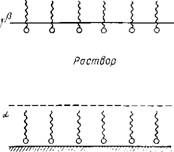
Рис. 12.10. Схема, иллюстрирующая ориентацию адсорбированных молекул ПАВ на граничных поверхностях
Клинивающего давления, тем большем, чем больше степень адсорбции. Причиной такого влияния может быть униполярная ориентация молекул алкилоламидов на поверхностях раствор — стекло и раствор— воздух (рис. 12.10) и проявление диполь-дипольного взаимодействия между ними, а также адсорбционной составляющей расклинивающего давления [550].
Адсорбция дифильных молекул, вероятно, сказывается различным образом на зависимости энергии пленки от ее толщины h. При больших толщйнах диполь-дипольное взаимодействие молекул должно приводить к увеличению глубины вторичного минимума U2 шт. При малых значениях h, сравнимых с удвоенным размером молекул ПАВ, следует ожидать противоположного влияния адсорбционных слоев на утончение пленки, поскольку последнее связано с необходимостью переориентации диполей на одной из границ раздела фаз. Возможность заметного изменения молекулярной компоненты расклинивающего давления при адсорбции пАв на межфазных поверхностях подтверждается результатами расчетов, выполненных уже сравнительно давно [551] в соответствии с микроскопической теорией молекулярного взаимодействия конденсированных сред и, более строго, в работе [550] на основе макроскопической теории. Такие изменения особенно значительны при значениях h Порядка нескольких нанометров.
|
Воздух
Стекло |
Исходя из предположения о влиянии ПАВ на молекулярную составляющую расклинивающего давления и на соотношение энергетических минимумов U mm и U2 шіп, можно объяснить наблюдаемые экстремальные зависимости Pf(C) при различных рН (см. рис. 12.6). Существование зарядов противоположного — знака на границах жидкость — газ твердое тело — жидкость при рН = 2,75 (см. рис. 12.7, кривые 1 и 3) должно приводить к абсолютной неустойчивости fS-пленок. Этого, однако, не происходит. Напротив, такие жидкие слои могут быть более стабильны по сравнению с системами, образующимися при рН = 11,2 и характеризуемыми высокими значениями ^-потенциалов (см. рис. 12.7, кривые 2 и 4). Поэтому необходимо принять, что в случае разноименно заряженных границ раздела фаз потенциальный барьер определяется молекулярным взаимодействием, которое, в свою очередь, обусловлено адсорбцией ПАВ.
Обсуждая вопрос об изменении молекулярной составляющей расклинивающего давления при адсорбции ПАВ, нельзя исключить определенного влияния ионно-электростатической компоненты на вероятности превращений а — и fS-пленок. Роль последней отчетливо прослеживается при исследовании устойчивости жидких слоев в присутствии NaCl (см. рис. 12.8), а также в существенном различии кривых Pf(C) для ряда значений рН (см. рис. 12.6).
Ионно-электростатическая компонента расклинивающего давления, согласно [42, 45], зависит, главным образом, от потенциалов поверхностей, ограничивающих пленку. Поскольку изученные нами ПАВ являлись неионогенными и при их добавлении ионная сила дисперсионных сред оставалась постоянной, а концентрации ионов в отсутствие NaCl при рН = 6+7 были достаточно низки, в первом приближении можно полагать равенство электрокинетических и штерновских потенциалов. Следовательно, обнаруживаемое в опыте повышение ^-потенциала при увеличении содержания ПАВ в интервале от 1-Ю"7 до 1-Ю-5—1-Ю-4 моль/дм3 (рис. 12.5) обусловлено вытеснением из слоя Штерна сильно гидратированных ионов водорода. По мере заполнения адсорбционного слоя ПАВ, возможно, происходит уменьшение поверхностной концентрации гидроксил-ионов, что вызывает снижение ^-потенциала при концентрации ПАВ Ю-"—Ю-3 моль/дм3.
Изучение динамического равновесия ос — и ^-пленок и их взаимных переходов создает возможность целенаправленного регулирования массообмена в процессах сушки дисперсных материалов.
 24 октября, 2012
24 октября, 2012  admin
admin 
 Опубликовано в рубрике
Опубликовано в рубрике 