При получении пигментов протекают два основных процесса: химическая реакция и кристаллизация. Основными типами реакций при синтезе пигментов являются ионные реакции обмена, окислительно-восстановительные и реакции разложения. Они протекают в водных растворах, в твердой фазе и на границе раздела фаз. Подробно эти реакции будут рассмотрены при описании конкретных пигментов. Остановимся кратко на особенностях проведения этих реакций.
В водной среде реакции протекают при сливании двух или более растворов исходных веществ с большой скоростью. Концентрации растворов, как правило, составляют 10—12% (масс.). Синтез проводится при умеренных температурах (20—90°С). При проведении реакции необходимо перемешивать реакционную массу. Равновесие реакций сдвинуто в сторону образования нерастворимого в воде пигмента. В водной среде получают хроматы свинца, железную лазурь и другие пигменты.
В твердой фазе реакции протекают при переносе (диффузии) Ионов по дефектам кристаллической решетки. Скорость и полнота завершения реакции зависят от степени дисперсности исходных компонентов, степени их контакта, температуры и давления. Реакции протекают при высоких температурах—от 350 до 1200 °С. При перемешивании реакционной массы процесс значительно ускоряется. В твердой фазе получают ультрамарин, оксиды хрома и другие пигменты.
В ряде случаев реакции протекают на границе раздела фаз. Это главным образом реакции окисления кислородом воздуха твердых веществ или расплавов металла. Скорость реакции сильно зависит от температуры, которая обычно составляет 600—1100 °С, от величины поверхности раздела фаз (дисперсности окисляемого соединения), давления и интенсивности перемешивания. В качестве примеров пигментов, полученных окислением на границе раздела фаз, можно назвать оксиды свинца (глет и сурик).
Технологические способы получения могут включать описанные реакции в различных сочетаниях. Например, по реакции в водной среде можно получить соединение, которое затем подвергают термообработке для осуществления процессов в твердой фазе.
Протекание процессов кристаллизации достаточно сложно, однако знание их закономерностей необходимо для получения пигментов с определенными заданными свойствами.
Наиболее хорошо изучены процессы кристаллизации из водных растворов. Химическая реакция и выделение новой фазы (кристаллизация) могут протекать раздельно. В других случаях оба эти процесса так тесно связаны, что разделить их невозможно.
К первому случаю относится осаждение пигментов из раствора за счет реакций обмена. Например, соли свинца и хроматы реагируют при смешении их водных растворов с образованием первоначально пересыщенного раствора хромата свинца, из которого затем выделяется твердый осадок.
Ко второму случаю, при котором химическая реакция и образование новой фазы протекают совместно, относятся процессы осаждения оксидов путем гидролиза солей или при реакции обмена.
Процесс фазового превращения можно разделить на три кинетические стадии: образование зародышей; рост зародышей до макроскопических кристаллов; агрегация двух или нескольких кристаллов с образованием более крупных частиц.
Возможность вещества перейти из раствора в осадок определяется законом действующих масс. Константой равновесия реакции осаждения является произведение растворимости ПР. Для реакции
РА+ + QB~ ApBq
Произведение растворимости равно:
Где ад+ и ав——— активности соответствующих ионов.
В том случае, когда произведение активностей реагирующих ионов превысит ПР, равновесие сместится вправо, т. е. в растворе окажутся недиссо — циированные молекулы, которые будут собираться в агрегаты. Эти агрегаты и являются зародышами новой фазы. Скорость их образования называют скоростью агрегации. Молекулы в агрегатах вначале располагаются хаотично, что является термодинамически невыгодным, поэтому происходит их самопроизвольная ориентация, что приводит к появлению дальнего порядка, и агрегаты превращаются в кристаллы. Скорость этого процесса называют скоростью ориентации.
Степень кристалличности и форма кристаллов зависят от соотношения скоростей агрегации и ориентации. Скорость агрегации зависит от степени пересыщения, т. е. отношения концентрации вещества в растворе с к его концентрации насыщения с».
Графически эта зависимость приведена на рис. 5.11.
Как видно из рисунка, скорость образования агрегатов вначале очень мала, а затем резко возрастает при достижении степенью пересыщения с! Соо критической величины.
Скорость ориентации молекул в агрегатах зависит от их свойств и прежде всего от их полярности: чем выше полярность, тем больше склонность молекул к ориентации. Размер образующихся зародышей зависит от степени пересыщения и определяется формулой:
Г = (с/С оо — 1)!]*,
Где K — постоянная величина; г) — вязкость раствора; г — радиус зародышей.
При концентрациях, меньших растворимости вещества, процесс кристаллизации самопроизвольно протекать не может. Когда же концентрация вещества становится больше его растворимости (пересыщенный раствор), в этом случае возможно начало кристаллизации, т. е. появление зародышей, изменение свободной энергии AF зависит от размера образующихся кристаллов. При исследовании функции AF=f(r) установлено, что она проходит через максимум. Размер зародыша, соответствующий экстремуму (максимуму), носит название критического — гк. Кристаллы, имеющие размеры несколько больше гк, будут самопроизвольно расти, а имеющие размеры несколько меньше гк — растворяться, так как и в том, и в другом случае AF будет уменьшаться. Это согласуется со вторым законом термодинамики, по которому необходимым условием протекания какого-либо процесса является убыль свободной энергии.
Когда к зародышам критического размера присоединяется еще некоторое число молекул, образуется свободно растущий кристалл. Рост кристалла представляет собой сложный и многостадийный процесс, который включает, например, диффузию молекул к поверхности частицы, адсорбцию на поверхности частицы, внедрение в кристаллическую решетку и т. д. Рост кристалла катализируют винтовые дислокации, при этом процесс облегчается при наличии на ступенях дислокаций точечных дефектов.
|
|
Рис. 5.11. Зависимость скорости агрегации частиц V от степени пересыщения раствора
Рис. 5.12. Зависимость скорости роста кристаллов от пересыщения раствора
Скорость роста кристалла зависит от пересыщения раствора, причем при малых значениях пересыщения зависимость подчиняется параболическому закону, а при больших значениях — линейному (рис. 5.12).
Образовавшиеся кристаллы вещества (пигментов) могут слипаться за счет поверхностных сил взаимодействия. В результате образуется осадок, состоящий из частиц, представляющих собой агрегаты двух и более первичных кристаллов. Образование таких агрегатов приводит к уменьшению степени дисперсности пигментов, от которой зависит целый ряд их ценнейших свойств. Поэтому технологический процесс проводят так, чтобы избежать излишнего агрегирования частиц, и, кроме того, готовый пигмент подвергают тщательному механическому измельчению.
|
|
В результате кристаллизации из растворов получают полидисперсные порошки. Распределение частиц по размерам является их важнейшим свойством (особенно для пигментов) и зависит от способа проведения кристаллизации. Различают непрерывную и периодическую кристаллизацию. При непрерывной кристаллизации кристаллы осаждаются при смешивании двух (или более) растворов, которые непрерывно подают в реакционный аппарат. Образующаяся суспензия выводится из аппарата также непрерывно. При достижении равновесного состояния пересыщение, скорость образования зародышей и средняя скорость кристаллов становятся постоянными. По мере образования зародышей часть их выводится из аппарата. Поэтому в готовом продукте будут присутствовать мелкие кристаллы в большом количестве, и чем они крупнее, тем меньше их образуется (рис. 5.13,а). Распределение частиц по размерам можно регулировать продолжительностью нахождения их в аппарате (продолжительностью отстоя). Чем больше будет это время, тем более пологой будет кривая.
Рис. 5.13. Распределение числа частиц пигментов по размерам при непрерывной (а) и периодической (б) кристаллизации
При периодической кристаллизации пересыщение должно наступать мгновенно, например при встряхивании двух растворов. Образующиеся зародыши затем растут, а пересыщение уменьшается. Поэтому скорость образования новых зародышей будет уменьшаться. В системе всегда будет находиться большое количество крупных кристаллов (см. рис. 5.13, б).
Процессы кристаллизации из газовой фазы имеют много общего с кристаллизацией из растворов. Процессы кристаллизации в твердой фазе наименее изучены. Формально они также подразделяются на стадии образования и роста зародышей. Фазовые превращения в твердой фазе возможны только при условии, что они ведут к понижению свободной энергии системы. Скорость же превращений зависит от ряда факторов и, в частности, от наличия в структуре дефектов. Так, например, образование зародышей происходит преимущественно на границах зерен и дислокациях. Стадия роста зародышей определяется скоростью диффузии атомов или ионов, а диффузионные процессы протекают на границе зерен с большей скоростью, чем в объеме.
 1 ноября, 2012
1 ноября, 2012  admin
admin 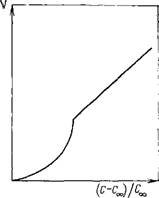

 Опубликовано в рубрике
Опубликовано в рубрике 