В данном разделе рассматриваются поверхностно-активные вещества дифильного строения, обладающие рядом специфических свойств, которые обусловили их широкое применение в различных промышленных отраслях. Как уже отмечалось, такие поверхностно-активные вещества получили сокращенное название ПАВ.
Наличие гидрофильной и олеофильной частей у молекул ПАВ является характерной отличительной особенностью их строения. По способности к диссоциации в водных растворах поверхностно-активные вещества делят на ионогенные и неионогенные. В свою очередь ионогенные ПАВ подразделяют на анионные, катионные и амфолитные (амфотерные).
Анионные ПАВ диссоциируют в воде с образованием поверхНостно-активного аниона. К ПАВ этого типа, составляющего большую часть мирового производства всех поверхностно-активных веществ, относятся:
А) карбоновые кислоты и их соли (мыла) общей формулы RCOOM (где М — металл), например пальмитат натрия Ci5H3iCOONa, стеарат натрия СиНзвСОСШа, олеат натрия C17H33COONa;
Б) алкилсульфаты R0S020M;
В) алкиларилсульфонаты RArS020M;
Г) вещества, содержащие другие типы поверхностно-активных анионов, например фосфаты, тиосульфаты.
В качестве ПАВ широкое практическое применение находят •соли синтетических жирных кислот фракции Сю—Ci7, заменяющие кислоты растительного и животного происхождения. В зависимости от назначения и условии применения используют соли жирных кислот с различными катионами, например соли жирных кислот с двух — и трехзарядными катионами применяют в углеводородных средах.
В кислых средах соли карбоновых кислот переходят в слабо — диссоциированные и малорастворимые кислоты, а в присутствии некоторых катионов (кальция, магния) образуют нерастворимые соли, что резко снижает эффективность их действия как ПАВ, особенно ухудшает их моющее действие. Большими преимуществами в этом отношении обладают алкилсульфаты и ал — килсульфонаты, которые являются солями сильных кислот и поэтому могут быть использованы в кислых и солевых растворах.
Катионные ПАВ диссоциируют в воде с образованием поверхностно-активного катиона. К катионным ПАВ относятся:
А) соли первичных, вторичных и третичных алифатических л ароматических аминов;
Б) соли алкилзамещенных аммониевых оснований.
Катионные ПАВ — наиболее токсичные и наименее биологически разлагаемые из всех ПАВ; их часто используют в качестве бактерицидных, фунгицидных, дезинфицирующих веществ, ингибиторов коррозии.
Амфолитные ПАВ содержат две функциональные группы, одна из которых имеет кислый, а другая основный характер, например карбоксильную и аминную группы. В зависимости от рН среды амфолитные ПАВ проявляют анионоактивные или катионоактивные свойства:
Щелочная кислая —F
RNH(CH2)„COO — ——————— Т RNH(CH2)„COOH RNH2(CH2)„COOH
Среда среда
Анионоактивные катионоактивные
Свойства свойства
Неионогенные ПАВ не диссоциируют в растворах на ионы. Методы их получения основаны на реакции присоединения эти — леноксида к спиртам, карбоновым кислотам, аминам, алкилфе — нолам и другим соединениям. Например, оксиэтилированные алкилспирты маркн ОС синтезируют по реакции
ROH + яН2С———— СН2 ——— RO(OCH2CH2)„H
Перспективными являются оксиэтилированные жирные кислоты RC00(CH2CH20)nH. В молекулах неионогенных ПАВ углеводородный радикал может содержать от 6 до 18 углеродных атомов, а п может изменяться от нескольких единиц, до ста. Как правило, неионогенные ПАВ являются смесью гомологов с различной длиной полиоксиэтиленовой цепи.
Полиоксиэтиленовая цепь определяет гидрофильные свойства неионогенных ПАВ. Изменяя длину полиоксиэтиленовой цепи, легко регулировать их коллоидно-химические свойства. Эти ПАВ применяются в любых средах (кислой и щелочной), а также в присутствии растворимых солей. Полиоксиэтиленовые эфиры алкилфенолов марки ОП обладают хорошими моющими ■ свойствами.
К недостаткам этих ПАВ относится медленное разложение из-за наличия в их составе ароматического радикала и, как следствие, накопления их в объектах окружающей среды. Не — ионогенные ПАВ с алкильными радикалами способны биологически разлагаться достаточно полно и быстро.
Поведение ПАВ в растворах в значительной степени зависит от природы растворителя — среды. В зависимости от среды одно и то же вещество может вести себя по-разному. Например, иодид тетрапентиламмония [N(C5Hh)4]I в воде и ацетоне диссоциирует на ионы, в хлороформе ассоциирует, а в тетрахлори — де углерода образует тоддлейдный раствор. Обычно свойства ПАВ характеризуют по отношению к воде, и поэтому они зависят в основном от природы и строения ПАВ.
Все дифильные поверхностно-активные вещества относительно поведения их в воде делят на истинно растворимые и коллоидные.
К первой группе относится большой класс растворимых в воде дифильных органических соединений с небольшим углеводородным радикалом, например низшие спирты, фенолы, кислоты и их соли, амины. Вещества этого типа в растворе находятся в молекулярно-дисперсном состоянии вплоть до концентраций, соответствующих их насыщенным растворам и разделению системы на две сплошные фазы. Эти вещества применяются в качестве смачивателей, вспенивателей, гидрофобизаторов при •флотации, диспергаторов, облегчающих процессы образования новых поверхностей, и т. д.
Особый интерес представляют коллоидные поверхностно-активные вещества. Именно они в первую очередь понимаются под термином ПАВ. Главной отличительной особенностью этих веществ является способность образовывать термодинамически устойчивые (лиофильные) гетерогенные дисперсные системы (ассоциативные, или мицеллярные, коллоиды). К основным свойствам коллоидных ПАВ, обусловливающим их ценные качества и широкое применение, относятся высокая поверхностная активность; способность к самопроизвольному мицеллообразо — ванию — образованию лиофильных коллоидных растворов при концентрации ПАВ выше некоторого определенного значения, называемого критической концентрацией мицеллообразования (ККМ); способность к солюбилизации — резкому увеличению ^растворимости веществ в растворах коллоидных ПАВ вследствие их «внедрения» внутрь мицеллы; высокая способность стабилизировать различные дисперсные системы.
ВйСОкая «поверхностная активность коллоидных ПАВ зависит, главным образом, от длины углеводородного радикала. Увеличение длины радикала на одну группу СН2 приводит к возрастанию поверхностной активности приблизительно в 3,2 раза (правило Дюклю.— Траубе). Это правило соблюдается в •основном для истинно растворимых ПАВ. Так как поверхностную активность определяют при бесконечном разбавлении системы, то легко объяснить ее зависимость от длины углеводородного радикала. Чем длиннее радикал, тем сильнее выталкивается молекула ПАВ из водного раствора (уменьшается ее растворимость) и тем больше константа Генри, которая для ЛАВ пропорциональна поверхностной активности [см. уравнение (111.123)]. Изменение работы адсорбции Д^адс или энергии Гиббса адсорбции, взятой с обр атным знаком —Д^/адс» можно лредставить следующим образом
ДЦГадс=_ДОадс=срЛГА/г (VI.38)
Тде ф — работа адсорбции молекулы ПАВ, отнесенная к одной СН2-группе; Л — число СН2-групп в молекуле ПАВ; NA — число Авогадро.
Константа Генри связана с работой адсорбции соотношением Кт=А/с=ехр [— ДОадс/(#Л]=ехр [<PNAn/RT] (VI.39)
Где А — величина адсорбции ПАВ; с — равновесная концентрация ПАВ в •объеме раствора.
Соотношение (Л/1.39) показывает, что константа Кг> а следовательно, и поверхностная активность с увеличением числа СН2-групп в молекуле ПАВ возрастают в кратное число раз. Для двух соседних членов гомологического ряда ПАВ при постоянной температуре отношение поверхностных активностей |см. уравнение (VI.39)] составляет:
Gn+i/g„=exp [ф/V д/ (ЛТ) ]=Const (VI.40)
Отношение (VI.40) отражает правило Дюкло — Траубе. Она является постоянной величиной и для водных растворов пр»’ 20°С составляет «3,2. При температурах, отличных от 20°СГ постоянная имеет другие значения. Поверхностная активность: пропорциональна также константе, входящей в уравнение’; Ленгмюра (или уравнение Шишковского), так как Кт = КАа^ (III.17) и Л» — емкость монослоя — постоянна для данного гомологического ряда. Для органических сред правило Дюкло — Траубе обращается: поверхностная активность снижается с уве* личением длины углеводородного радикала ПАВ.
При большой длине углеводородных радикалов, когда за* метно проявляется взаимодействие между молекулами ПАВ на поверхности, поверхностная активность увеличивается медлен*
нее, чем это следует из правила Дюкло — Траубе. И все же с увеличением длины углеводородного радикала поверхностная активность ПАВ повышается. Так, константа распределения Генри для коллоидных ПАВ может достигать значения 10 000 в более.
Кроме поверхностной активности, непосредственно определяющей адсорбционную способность ПАВ, другой важной количественной характеристикой коллоидных ПАВ является гид- рофильно-липофильный баланс (ГЛБ). Соотношение между гидрофильными свойствами полярной группы и липофильными (липос — жир) свойствами углеводородного радикала, зависящими от его размера, характеризуется числами ГЛБ. Числа ГЛБ определяются путем сравнения способности различных ПАВ к мицеллообразованию, стабилизации эмульсий и др.
Наиболее распространенный метод определения чисел ГЛБ — метод Гриффина — основанный на сравнении способности ПАВ образовывать устойчивые эмульсии типа вода — масло или масло — вода. Условно выбраны значения ГЛБ для олеата натрия—18, триэтаиоламина — 12, олеиновой кислоты—1. Чем выше гидрофильность, тем больше число ГЛБ.
Определение чисел ГЛБ проводят следующим образом. Готовят эмульсин из воды и стандартного масла с эмульгаторами из смесей ПАВ с известным и неизвестным значениями ГЛБ. Эмульсии выдерживают 24 ч, затем определяют наиболее устойчивую эмульсию или фиксируют обращение эмульсин и рассчитывают ГЛБ исследуемого ПАВ, считая это свойство аддитивным, по формуле
Ггтп ^аГЛБД 4- ^вГЛБв
ГЛБСМ=>————— WA + WB————— (VI.41)
Где ГЛБсм—число ГЛБ смеси ПАВ, обеспечивающее получение устойчивой эмульсии стандартного масла; WK — количество эмульгатора А с известным ГЛБА; WB—количество эмульгатора В с неизвестным ГЛБв. Имеются и другие эмпирические методы определения чисел ГЛБ. Для вычисления ГЛБ ■оксиэтилироваиных продуктов пользуются формулой Гриффина:
ГЛБ = (сэт+Ссп)/5 (VI.42)
Тде сэт и Ссп;—соответственно содержание этиленоксида и спирта, % (масс.).
Для производных этиленоксида и веществ, в которых гидрофильной Труппой является этилеиоксид, это выражение переходит в следующее:
ГЛБ=сэт/5 (VI.431
Работами Девиса установлена количественная зависимость ГЛБ от состава и структуры ПАВ. Каждая структурная единица вносит свой вклад в числа ГЛБ. Числа ГЛБ по Гриффину составляют
Для гидрофильных групп: —COOK —21,1; —COONa —19,1; —СООН —2,4; —ОН — 1,9; =0— 1,3
И для гидрофобных групп = СН— —СН2—, —СН3, =С= —0,475
На основании этих данных числа ГЛБ можно рассчитать в соответствии е Уравнением
|
337 |
ГЛБПАв= 7+ S (ГЛБ)г — 2 (ГЛБ)л <VI.44>
Где 2 (ГЛБ)г — сумма чисел ГЛБ всех гидрофильных групп; 2 (ГЛБ)л — сумма чисел ГЛБ липофнльиых (гидрофобных) групп.
Следует иметь в виду, что в этой формуле ие учитывается число СН2- групп, составляющих полиоксиэтилеиовую цепь.
Физический смысл эмпирических чисел ГЛБ состоит в том, что они определяют отношение работы адсорбции молекул ПАВ на границе раздела из фазы «масло» к работе адсорбции на той же границе из фазы «вода». Таким образом, числа ГЛБ линейно связаны с константой Генри и поверхностной активностью. Именно-эти параметры должны быть критериями оценки ПАВ. Однако на практике обычно качество ПАВ оценивают по числам ГЛБ. Так, для получения устойчивых прямых эмульсий (масло в воде) используют ПАВ с числами ГЛБ от 10 до 16 (в зависимости от природы масла), для получения обратных эмульсий (вода в масле)—от 3 до 5; при ГЛБ 7Ч-8 наблюдается переход эмульсий от прямых к обратным; числа ГЛБ составляют для смачивателей 7-=-9, моющих средств 13—15, со — любилизаторов в водных растворах— 15-М6.
В заключение можно отметить, что основной количественной характеристикой ПАВ является поверхностная активность, которая определяет их способность понижать поверхностное натяжение, вызывать эмульгирование, пенообразование, диспергирование и стабилизацию, смачивание и другие явления и процессы.
|
Рис. VI.3. Изотерма поверхностного натяжения коллоидных ПАВ, иллюстрн- ‘ рующая начало мицеллообразования в точке ККМ Рис. VI.4. Фазовая диаграмма раствора коллоидного ПАВ Cs — растворимость ПАВ в воде |
Стоянным. Концентрация в точке излома соответствует критической концентрации мицеллообразования (ККМ), выше которой в растворе самопроизвольно протекают процессы образования мицелл и истинный раствор переходит в ультрамикрогетероген — ную систему (золь).
Более резко точка излома выявляется на изотерме, построенной в координатах а — Lg с (для неионогенных ПАВ) или а — lg cv (для ионогенных ПАВ) в соответствии с уравнением (11.70)—Da = TRTdN а (рис. VI.3). При полном заполнении монослоя (Г = Л<х>) постоянному значению о соответствует постоянное значение химического потенциала ПАВ в растворе, что определяет процесс мицеллообразования как процесс образования новой фазы. Поверхностную активность коллоидных ПАВ можно приближенно оценить через ККМ с помощью соотношений
Для неионогенных ПАВ G » (о0—аКкм>/ККМ (VI.451
Для ионогенных ПАВ G± » (о0 — OKkm)/(KKM)v (VI.46)
Где о0 — поверхностное натяжение растворителя (воды).
У коллоидных ПАВ предельные значения о0—оккм для границы раздела фаз вода — воздух мало отличаются и составляют около 71,5-10-3—28• 10-3 = 43,5• ГО-3 Дж/м[5]. Значения ККМ Различаются на 2—3 порядка, поэтому можно считать, что по — верхностная активность коллоидных ПАВ обратно пропорциональна ККМ. Соотношения (VI.45) и (VI.46) устанавливают связь между поверхностными и объемными свойствами ПАВ’.
При концентрациях выше ККМ молекулы ПАВ собираются в Мицеллы (ассоциируют) и раствор переходит в мицеллярную
(ассоциативную) коллоидную систему. Растворы коллоидных TIAB являются классическим примером лиофильных гетерогенных систем — самопроизвольно образующихся равновесных систем с минимумом энергии Гиббса, несмотря на огромную межфазную поверхность.
Под мицеллой ПАВ понимают ассоциат дифильных молекул, лиофильные группы которых обращены к соответствующему растворителю, а лиофобные группы соединяются друг с другом, образуя ядро мицеллы. Число молекул, составляющих мицеллу, называют числом ассоциации, а общую сумму молекулярных масс молекул в мицелле, или произведение массы мицеллы на число Авогадро, — мицеллярной массой. Обратимость лиофильных мицеллярных систем заключается в том, что при разбавлении растворов мицеллы распадаются на молекулы или ионы, и система переходит в истинный раствор.
Определенное ориентирование дифильных молекул ПАВ в мицелле обеспечивает минимальное межфазное натяжение на границе мицелла — среда. Соответственно сравнительно небольшая поверхностная энергия может быть скомпенсирована энтропийной составляющей системы.
Многие ПАВ с большими углеводородными радикалами из — за плохой растворимости не образуют мицеллярных растворов. Однако при изменении температуры растворимость ПАВ может увеличиваться и обнаруживается мицеллообразование. Температуру, при которой резко увеличивается растворимость ПАВ вследствие образования мицелл, называют точкой Крафта (1896 г.).
Как следует из определения, точка Крафта Тк отвечает ККМ на фазовой диаграмме коллоидного ПАВ (рис. VI.4). Если величина ККМ характеризует нижний предел концентрационной области существования мицеллярных растворов, то Тк — нижний температурный предел. Кривая аО на фазовой диаграмме соответствует температурной зависимости истинной растворимости ПАВ, которая медленно растет до точки Крафта. Эта кривая отвечает равновесию между чистым ПАВ (или его гидратом) и истинным раствором ПАВ. Кривая оЪ показывает зависимость мицеллярной растворимости от температуры (равновесие между чистым ПАВ и его мицеллярным раствором). Участок ос отвечает изменению ККМ от температуры (равновесие между мицеллами и мономерами ПАВ). Таким образом, точка Крафта 7к является тройной точкой на фазовой диаграмме ПАВ — растворитель (вода). В этой точке существует равновесие между тремя фазами: чистое ПАВ — мицеллярный раствор ПАВ — истинный раствор ПАВ. Точка Крафта снижается с уменьшением углеводородного радикала, его разветвлением, при наличии кратных связей, с введением полярных групп, т. е. с увеличением раство]римости ПАВ.
Установлено, что мицеллообразованию предшествует ассоциация молекул ПАВ в димеры, тримеры и т. д. Однако для водных растворов ПАВ наличие резких изломов в области ККМ на кривых физико-химическое свойство — концентрация служит достаточным основанием принимать во внимание только два состояния ПАВ в растворе при концентрациях выше ККМ. Это мономерное и мицеллярное состояния ПАВ с определенным числом ассоциации, между которыми существует термодинамическое равновесие. С ростом концентрации ПАВ в растворе концентрация мономера увеличивается ненамного, а количество мицеллярной фазы растет почти пропорционально, начиная с незначительного числа мицелл. Эта закономерность подтверждает справедливость рассмотрения мицеллообразования как процесса возникновения новой фазы. Кроме того, появляется возможность описать мицеллообразование как химическую реакцию ассоциации. Однако нельзя не учитывать того, что термодинамическая активность мицелл (микрофазы) может существенно отличаться от термодинамической активности макрофазы ПАВ.
Процесс мицеллообразования в соответствии с законом действия масс можно выразить для неионогенных и ионогенных ПАВ с помощью уравнений
/я (ПАВ) з* (ПАВ)т и NK+ + MR— м(т-">-
Где К+ — противоионы; R — — поверхиостно-активиый аииои; М — мицелла; т — число R в мицелле.
Константы равновесия этих реакций будут равны соответственно
«йеной ^Ж^Ж. Ж (VM7)
«нон см УМ (VI 48>
Тде а, ак+ и ви-— активности молекулярно растворенного ПАВ, противоионов К.+ и полииоиов R — соответственно; "( и —коэффициенты активности иеионогенного ПАВ соответственно в моиомериом и мицеллярном состоянии; Т(к+, Kr-h "Jm — коэффициенты активности соответственно противоионов, полииоиов и мицелл ионогенного ПАВ.
Стандартная энергия Гиббса мицеллообразования, приходящаяся на 1 моль мономера, составит
ОТ
AG°M=i-—lnK (VI.49)
Подставляя вместо константы равновесия мицеллообразова — «ия ее значение из (VI.47), принимая коэффициенты активности, равными единице (так как раствор разбавленный), а также учитывая равенство с = ККМ, получим, например, для неионогенных ПАВ:
А^^-^’п-щй). (vi.50)
Таким образом, рассмотрение мицеллообразования с использованием закона действия масс позволяет определить термодинамические функции этого процесса по значению ККМ и активности мицелл в этой области концентраций. Часто активность мицелл принимают равной единице, однако это допущение далеко неправомерно, так как при таком условии не происходило бы растворения ПАВ (равенство активностей мицелл и макрофазы ПАВ), что противоречит эксперименту. Активность мицелл можно определить, например, методом распределения ПАВ между двумя жидкими фазами.
Термодинамическое рассмотрение процесса мицеллообразования позволяет сделать вывод о том, что с увеличением сродства молекул ПАВ к растворителю (их лиофильности) устойчивость мицелл снижается и соответственно увеличивается ККМ: молекулам ПАВ труднее собираться в мицеллу. То же самое наблюдается при повышении степени диссоциации молекул ПАВ и росте заряда мицеллы: увеличивается энергия отталкивания одноименно заряженных лиофобных ионов, образующих ми-, целлы.
На процесс мицеллообразования в водных растворах существенно влияет структура воды, которая способствует выталкиванию углеводородных радикалов из раствора; одновременно частично разрушается структура раствора. Благодаря дифиль — ному строению молекул ПАВ углеводородные радикалы, взаимодействующие между собой в мицеллах, экранируются гидрофильными группами. Поэтому происходит самопроизвольное мицеллообразование с минимальным поверхностным натяжени-* ем на границе раздела мицелла — вода, сопровождающееся уменьшением энергии Гиббса системы.
Эффектом экранирования объясняется уменьшение энтальпии в процессе мицеллообразования. Взаимодействие отдельных частей молекулы ПАВ в. молекулярном растворе с растворителем характеризуется различным по знаку изменением энтальпии: лиофильная часть взаимодействует с выделением теплоты, лиофобная — с поглощением теплоты. Имегіно поэтому энтальпия растворения ПАВ имеет небольшие положительные или отрицательные значения (чаще всего для водных растворов она положительна). В мицеллярном растворе экранирование лиофобных групп приводит к уменьшению поглощения теплоты, т. е. к снижению энтальпии коллоидной системы по отношению к энтальпии образования истинного раствора. Так как мицеллообразование можно рассматривать как возникновение новой
фазы, то его можно сравнить с расслоением системы, т. е. с процессом ее упорядочения. Для таких процессов характерно уменьшение энтропии. Таким образом, самопроизвольное ми — целлообразование по сравнению с образованием молекулярного раствора обусловлено уменьшением энтальпии [см. уравнение (VI.23)].
Если же процесс мицеллообразования рассматривать как самопроизвольное диспергирование, т. е. образование мицел — лярного раствора из макрофаз компонентов, то, очевидно, такой процесс будет обеспечиваться энтропийной составляющей как процесс, приводящий систему в то же самое равновесное состояние, но с другой стороны.
При образовании мицелл ПАВ в растворе возможно их формирование и на межфазной поверхности. Мицеллы образуются на поверхности, если работа адсорбции (адгезии) меньше работы ассоциации молекул ПАВ. В противном случае они, выходя. на поверхность, разрушаются.
.
 2 ноября, 2012
2 ноября, 2012  admin
admin 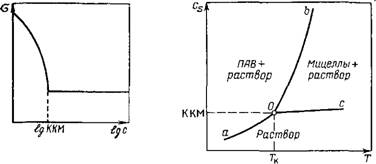
 Опубликовано в рубрике
Опубликовано в рубрике 