Еще 20—40 лет тому назад существовали две теории растворов полимеров. Согласно одной из них (мицеллярная теория), развитой Майером и Марком, макромолекулы находятся в растворе в виде мицелл, согласно второй — достаточно разбавленные растворы высокомолекулярных веществ содержат отдельные, друг с другом не связанные макромолекулы (молекулярная теория).
В соответствии с мицеЛлярной теорией кинетическими единицами в растворе высокомолекулярных веществ являются пачки макромолекул, удерживаемые вместе межмолекулярными силами. Основанием для создания этой теории послужил взгляд на полимеры как иа кристаллические вещества, состоящие из кристаллитов (мицелл) — пучков из 40—60 ориентированных макромолекул. Предполагалось, что при растворении эти кристаллиты не распадаются, а продолжают существовать в растворе. Представления, положенные в основу мицеллярной теории, по существу являлись переносом на раство’ры высокомолекулярных веществ представлений о природе типичных коллоидных систем — лиозолей/ И те и другие системы признавались гетерогенными, термодинамически неравновесными и неустойчивыми. Различие между этими двумя типами систем видели в том, что для обеспечения агрегативной устойчивости типичных лиозолей в них должен быть стабилизатор, в то время как растворы высокомолекулярных веществ достаточно устойчивы и без стабилизатора из-за большого сродства дисперсной фазы к дисперсионной среде. Поэтому растворы высокомолекулярных веществ раньше обычно и назывались «лиофилными коллоидными системами»,
Весьма сильной сольватацией объясняли и отличия других свойств растворов полимеров и типичных гидрофобных золей. Высокую вязкость растворов полимеров объясняли либо энергетическим связыванием растворителя, либо его иммобилизацией в мицеллах полимера. Более быстрое возрастание осмотического давления в растворах полимера с увеличением концентрации вещества, чем это требуется по линейному закону, также интерпретировали, исходя из того, что в этих растворах растворитель частично связывается полимером и в результате этого увеличивается отношение числа частиц дисперсной фазы к числу молекул свободного растворителя.
Однако представление о каком-то особом сродстве полимеров к растворителям не имеет достаточных оснований. Еще в 1932 г. Маринеско, определяя количество воды, энергетически связываемой крахмалом, путем сравнения значений диэлектрической проницаемости раствора со значениями диэлектрических проницаемостей его компонентов получил данные, указывающие, что это количество воды незначительно и приблизительно соответствует образованию мономолекулярного слоя. А. В. Думанский, а также С. М. Липатов в результате калориметрических исследований пришли к такому же выводу. Наконец, к аналогичным выводам пришел и А. Г. Пасынский, определявший сольватацию по сжимаемой части растворителя. Этот метод основан на том, что в сольватной оболочке растворитель находится под большим внутренним давлением; сжимаемость он определял по скорости распространения ультразвука в растворах. Ниже приведены обобщенные результаты исследований А. Г. Пасынского по гидратации различных полярных групп ряда органических соединений:
Группа……………………………….. —ОН —СООН >СО —СНО
Число молекул воды, связываемых группой… 3 4 2 2
Еще более убедительны результаты исследований растворов полимеров в их собственных гидрированных мономерах. В этом случае говорить о сольватации вообще бессмысленно, поскольку силы взаимодействия между большими и малыми молекулами полимера и мономера имеют одну и ту же природу и должны быть примерно одинаковыми. Однако и здесь наблюдались все явления, характерные для растворе» полимеров. Все это опровергает представление о каком-то особом значении сольватации для устойчивости растворов полимеров и указывает на несостоятельность исходных положений мицеллярной теории.
В настоящее время мицеллярная теория потеряла свое значение. Как показали тщательные исследования, высокомолекулярные соединения в подходящих растворителях самопроизвольно диспергируются до отдельных молекул. Сходство типичных золей и растворов полимеров основано не на том, что и в этих системах существуют мицеллы, а на том, что в обоих случаях в растворе содержатся частицы сравнительно большого размера (в первом случае — мицеллы, во втором — макромолекулы).
Почти одновременно с мицеллярной возникла молекулярная теория. Один из авторов молекулярной теории Штаудингер представлял себе эти макромолекулы в растворе в виде жестких палочек. Однако впоследствии было показано, что поведение этих молекул в растворе более сходно с поведением свернутых в клубок гибких нитей.
Следует указать, что конформации свернутой нити в растворе в результате теплового движения все время меняются. В целом, однако, форма клубка всегда остается близкой к форме вытянутого эллипсоида вращения, Это подтверждается тем, что в то время как длина линейных макромолекул превосходит их поперечный размер в сотни и тысячи раз, экспериментально определенная степень асимметрии этих молекул в растворе достигает всего десяти.
Молекулярный клубок при не слишком большой длине цепл еще не плотен, и сквозь просветы может протекать растворитель. Однако по мере увеличения длины макромолекулы изогнутые участки цепи все больше закрывают просветы и в конце концов такой клубок почти полностью теряет способность пропускать растворитель, если, конечно, градиент скорости потока растворителя не достаточно велик для того, чтобы развернуть молекулярный клубок в вытянутую цепочку. Понятно, что чем жестче молекула, тем менее компактен клубок и тем сильнее он вытянут.
Макромолекулы в растворе, конечно, могут находиться в соль — ватированном состоянии. Однако, как уже указано, сольватация макромолекул в общем невелика, если под сольватно связанной средой понимать растворитель, энергетически взаимодействующий с полимером.
Молекулярная теория находит подтверждение в ряде фактов и наблюдений. Во-первых, определение молекулярных весов в разбавленных растворах полимеров методами, прямо указывающими молекулярный вес частиц (например, методом светорассеяния), однозначно показало отсутствие в таких растворах мицелл, т. е. частиц, состоящих из агрегатов молекул. Во-вторых, растворение высокомолекулярного вещества, как и растворение низкомолекулярных соединений, идет самопроизвольно, часто с выделением тепла. Например, достаточно желатин внести в воду, а" каучук в бензол, чтобы через некоторое время без какогб-либо вмешательства извне образовался раствор полимера в растворителе. При диспергировании же вещества до коллоидного состояния, как известно, требуется затрата энергии на преодоление межмолекулярных сил. В-третьих, растворы полимеров термодинамически устойчивы и при соответствующих предосторожностях могут храниться сколь угодно долго. Коллоидные растворы, наоборот, термодинамически неустойчивы и способны стареть. Это объясняется тем, что при растворении полимеров всегда образуется гомогенная система и свободная энергия уменьшается, как и при получении растворов низкомолекулярных • веществ, либо за счет выделения тепла в результате взаимодействия полимера с растворителем, либо за счет увеличения энтропии. При получении же гетерогенной коллоидной системы ее свободная энергия всегда возрастает в результате увеличения поверхности дисперсной фазы. В-четвертых, растворение высокомолекулярных соединений не требует присутствия в системе специального стабилизатора. Лиофобные же золи не могут быть получены без специального стабилизатора, придающего системе агрегативную устойчивость. Наконец, растворы полимеров находятся в термодинамическом равновесии и являются обратимыми системами: к ним приложимо известное правило фаз Гиббса. ■
Отдельные указания на применимость правила фаз к растворам высокомолекулярных веществ имелись еще в начале XX столетия. В. А. Каргин с сотр. подробно исследовал подобные системы и установил связь между применимостью правила фаз к растворению высокомолекулярных соединений и термодинамической устойчивостью и обратимостью растворов. Наиболее важной в этой области является работа В. А. Каргина, 3. А. Роговина и С. П. Папкова по исследованию растворов ацетата целлюлозы в различных растворителях — хлороформе, дихлорэтане, метиловом спирте, нитробензоле, метилэтилкетоне, метилпропилкетоне, бензоле, толуоле, этилацетате. Авторы установили, чтр при ограниченной рас — WCF творимоСти ацетата целлюлозы после расслаивания системы и достижения равновесия как в верхнем, так и в нижнем слое раствора устанавливается определенная концентрация ацетата целлюлозы в зависимости от температуры. Процесс растворения оказался строго обратимым и термодинамически равновесным, концентрации были одними и теми же при подходе к заданной температуре как путем нагревания, так и путем охлаждения. На рис. XIV, 4 в качестве примера приведена диаграмма состояния раствора ацетата целлюлозы в хлороформе. Эта диаграмма чрезвычайно сходна с диаграммой состояния двух ограниченно смешивающихся жидкостей с верхней критической температурой растворения. На основании этих данных авторы пришли к однозначному выводу, что растворы ацетата целлюлозы подчиняются правилу фаз и являются обратимыми системами.
Равновесность и обратимость растворов полимеров были также доказаны В. А. Каргиным, 3. А. Роговиным, А. А. Тагер и другими исследователями на опытах с бензилцеллюлозой, нитратом целлюлозы, поливинилхлоридом, желатином и другими высокомолекулярными веществами. Эти исседователи получали насыщенные растворы полимеров в плохих растворителях различными путями. Опыты показали, что если равновесие (расслоение раствора на две фазы или достижение предела растворения) достигалось при одной и той же температуре. и давлении, то всегда получались растворы одинаковой концентрации. Для перечисленных высокомолекулярных веществ были получены диаграммы состояния с верхней критической температурой растворения. Однако имеются данные, что для растворов метилцеллюлозы и этилцеллюлозы в воде получаются диаграммы с нижней критической температурой.
|
Во —
О І, о г, о з, о ч, о 5,0 6,0 р Ацетилцелпюлах% Рис. XIV, 4. Диаграмма состояния системы ацетил — целлюлозы — хлороформ. |
Все это свидетельствует о том, что при растворении высокомолекулярных веществ, как и при растворении низкомолекулярных
соединений, соблюдается правило фаз, не приложимое к коллоидным системам. Правда, установление равновесия в растворах полимеров вследствие их весьма большой вязкости может длиться весьма долго (например, несколько месяцев), и химику, получающему подобные системы, практически очень часто приходится иметь дело с неравновесными системами. Однако это не меняет существа вопроса
Все сказанное выше о том, что молекулы полимеров не связаны друг с другом и ведут себя вполне самостоятельно, верно лишь в том случае, когда они находятся в относительно разбавленных растворах. В концентрированных растворах, когда вероятность столкновения молекул растворенного вещества достаточно велика, макромолекулы могут взаимодействовать и образовывать так называемые рои, или асссоциаты. Эти ассоциаты, состоящие из сравнительно малого числа молекул и представляющие собой прообраз пачек, о которых мы уже говорили при рассмотрении структуры полимеров, обычно не обладают достаточной протяженностью и поэтому не могут считаться фазой. Кроме того, ассоциаты, в отличие от мицелл, существуют не постоянно, они возникают в одном месте, затем распадаются и снова возникают в другом. Таким образом, ассоциаты в разбавленных растворах полимеров не являются постоянно существующими образованиями и не имеют определенного состава.
Следует отметить, что образование ассоциатов характерно не только для растворов высокомолекулярных веществ. Ассоциаты образуются и в растворах низкомолекулярных веществ, а также и в индивидуальных жидкостях за счет столкновения и сцепления двух, трех, четырех и более молекул. Таким образом, явление ассоциации близко к явлению флуктуации плотностей в растворах и индивидуальных жидкостях. Особенностью образования ассоциатов в растворах высокомолекулярных веществ является то, что длинные и гибкие макромолекулы могут входить отдельными своими участками в состав различных ассоциатов.
Связи, которые образуются между макромолекулами, входящими в ассоциат, имеют ту же природу, что и связи между молекулами в ассоциатах, возникающих в низкомолекулярных системах. Эти связи могут образовываться за счет межмолекулярных взаимодействий, возникновения водородной связи, а в водных растворах и за счет электростатических сил. Какие силы превалируют. при образовании тех или иных ассоциатов, необходимо решать в каждом отдельном случае. При этом обязательно следует учитывать природу растворителя. Понятно, например, что в воде взаимодействие должно происходить, в основном, по углеводородным частям молекул, а в углеводородной среде по полярным группам,
* Более подробно о применимости правила фаз к растворам высокомолекулярных веществ см. Воюцкий С. С. Растворы высокомолекулярных соединений. Изд 2-е, М„ «Химия», 1960. См. с. 46.
На ассоциацию сильно влияет температура. С повышением температуры увеличивается тепловое движение ассоциатов, и это» ведет к их разрушению. Наоборот, понижение температуры способствует ассоциации.
Средний период жизни ассоциатов в растворах низкомолекулярных веществ очень мал и составляет около Ю-10 с. В растворах высокомолекулярных веществ средний период жизни ассоциатов. значительно больше, так как для того, чтобы громоздкие макромолекулы оторвались друг от друга, требуется гораздо больше времени. Процессы образования и разрушения ассоциатов при изменении температур-ы или концентрации обратимы, т. е. при заданных условиях среднестатистический размер ассоциатов в растворе высокомолекулярных веществ является вполне определенным. Однако поскольку периоды жизни ассоциатов, состоящих из макромолекул, более длительны, то, естественно, что равновесное значение степени ассоциации в растворах высокомолекулярных веществ устанавливается обыкновенно не сразу.
С увеличением концентрации растворов высокомолекулярных веществ или с понижением их температуры размер и длительность существования ассоциатов макромолекул увеличиваются. Это может привести к тому, что при известных условиях ассоциаты сделаются настолько большими и прочными, что их можно будет рассматривать как новую фазу. При образовании этой второй фазы система приобретает способность к расслаиванию, которое может проявиться, например, в коацервации — выделении новообразовавшейся фазы в виде мельчайших капель.
Благодаря тому, что макромолекулы имеют значительную длину и гибкость, а также могут входить в состав различных ассоциатов, явление ассоциации в растворах в итоге может привести и к образованию в системе пространственной сетки, что проявляется в застудневании раствора. Наличие таких сеток, обеспечивающих эластические свойства даже у сравнительно разбавленных растворов полимеров, было доказано Фрейндлихом и Зейфрицем же в начале XX столетия. В результате наблюдений под микроскопом эти исследователи установили, что если на мельчайшую — крупинку никеля в даже очень вязкой жидкости действует магнитное поле, то эта крупинка может перемещаться в жидкости на сколь угодно большое расстояние. В растворах же высокомолекулярных веществ крупинка передвигается в магнитном поле на очень небольшое расстояние и затем останавливается, а после прекращения действия поля возвращается в первоначальное положение под влиянием эластических сил, обусловленных существованием в растворе сетки из макромолекул. Застудневший раствор обычно со временем претерпевает синерезис, разделяясь на две фазы, — раствор высокомолекулярного вещества в растворителе и раствор растворителя в высокомолекулярном компоненте. Из сказанного следует, что ассоциаты — это не что иное, как зародыши новой фазы.
Наряду с растворами полимеров могут существовать и их дисперсии, обладающие всеми свойствами коллоидных систем (см. гл. XII, разд. 8). Частицы таких дисперсий представляют’-собой •большие агрегаты макромолекул.
 1 ноября, 2012
1 ноября, 2012  admin
admin 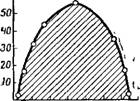
 Опубликовано в рубрике
Опубликовано в рубрике 