В этом разделе кратко рассмотрим электропроводность и диэлектрическую проницаемость лиозолей, так как эти свойства — тесно связаны с электрокинетическими явлениями, устойчивостью* и коагуляцией коллоидных систем.
Электропроводность лиозолей. Электропроводность лиозоля слагается из электропроводности, обусловленной коллоидными частицами, и электропроводности ионов, присутствующих в системе. Поэтому электропроводность коллоидного раствора зависит от заряда, числа и подвижности коллоидных частиц и ионов, находящихся в золе.
Нетрудно представить себе соотношение между электропроводностью, обусловленной коллоидными частицами, и электропроводностью за счет ионов, присутствующих в золе. Примем, что в золе содержится 1 объемн.% дисперсией фазы, — радиус частиц г = 50 А и {-потенциал составляет 100 мВ в дисперсионной среде, для которой х = 105. Для заряда частиц, по аналогии с уравнением (VII, 31), можно написать уравнение:
Q=reS(I+*r) (VII, 65>
Если ие учитывать электрическую релаксацию, то электрофоретическую по» двлжность частиц можно выразить соотношением:
0 бЯТ)
Число частиц v, содержащихси в единице объема коллоидного раствора, составляет:
0,01 V = — ҐГ—г
Тогда удельная электропроводность уколл, обусловленная коллоидными частицами, будет равна:
Y^^vifc-reCU+Kr)-^—^—————————————————- (VII,66)
Если в последнее уравнение подставить принятые выше значения к и г, значения в и (| для воды, а удельную электропроводность выразить в практических единицах, то получим:
Уколл х 4 • Ю-5 Ом-1 • см-1
Электропроводность же дисперсионной среды, для которой х = 10®, составляет примерно Ю-6 Ом-1-см-1. Таким образом, электропроводность, обусловленная присутствием в золе коллоидных частиц, вполне измерима, если только частицы не слишком велики и концентрация золя не слишком мала,
Паули, а затем и друиие исследователи измеряли электропроводность гидрозолей с помощью кондуктометрического титрорания
Для определения ионных компонентов системы. С помощью кондуктометрического титрования, как показали А. И. Ра — 1 І бинович и его сотр., не только можно
■ ^ определить число противоионов, а сле
Довательно, и заряд коллоидных частиц, но также получить сведения относительно локализации и фиксации противо — С—» ионов в двойном слое. Поясним это на
Рис. VII, 33. Результаты следующем примере.
Кондуктометрического ти- На рис. VII, 33 в виде схематических Трования золя сульфида кривых приведены результаты кондукто — Мышьяка: метрического титрования растворами
/ — крипая титрования с КОН:
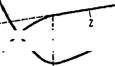
2—кризая титрования с Bad,! ГИДрООКИСИ КЭЛИЯ И ХЛОрИДЭ барИЯ ГИДРОЗОЛЯ сульфида мышьяка, для которого лотенциалопределяющим ионом является ион HS~, а противоио — ном — ион Н+. Как можно видеть, кривая / титрования с помрщью КОН имеет минимум. Существование этого минимума объясняется следующим образом. При добавлении первых порций щелочи происходит замещение в адсорбционном слое мицеллы противоиона Н+ на ион К и это приводит к образованию из ионов Н+ и ОН" почти неионизированной молекулы НгО. В результате уменьшения содержания ионов водорода, обладающих исключительно высокой подвижностью, электропроводность системы падает. Однако после замещения всех ионов водорода при дальнейшем добавлении щелочи электропроводность золя увеличивается. По количеству ще-
лочи, отвечающему минимуму на кривой, можно судить о количестве в золе связанных ионов водорода.
Кривая 2 титрования раствором ВаСЬ не имеет максимума и состоит из криволинейного и прямолинейного участков. Так как при титровании ВаСЬ вода не образуется, кривая не может иметь минимума, и по мере титрования происходит постепенное увеличение электропроводности. Благодаря большей подвижности ионов Н+ по сравнению с ионами Ва2+ электропроводность золя в начале титрования растет больше, чем это соответствует количеству добавленного электролита, что и обусловливает характерную форму этого участка кривой. Точка перехода криволинейного участка в прямолинейный, соответствующая минимуму на кривой титрования щелочью, очевидно, отвечает полному замещению ионов водорода ионами бария. Дальнейшее введение раствора хлорида бария, конечно, может приводить только к линейному увеличению электропроводности.
При титровании как КОН, так и ВаСЬ получаются в общем совпадающие результаты. Ввиду большого адсорбционного потенциала ионов бария из мицеллы вытесняются все ионы Н+, находящиеся в адсорбционном слое.
При работе с другими гидрозолями и электролитами результаты могут быть иными. Так, опыты показали, что при титровании золя мастики электропроводность с самого начала прямо пропорциональна количеству добавленного электролита. Прямолинейная форма графика кондуктометрического титрования указывает на то, что в этом случае не происходит вытеснения иона водорода из адсорбционного слоя.
Таким образом, путем кондуктометрического титрования можно установить характер сил, за счет которых противоионы удерживаются в адсорбционном слое. Если результаты титрования•указывают на способность к обмену всех противоионов мицеллы, т. е. свидетельствуют об их способности вытесняться как из диффузного, так и адсорбционного слоя, то противоионы удерживаются в мицелле только в результате действия физических сил (электрических, адсорбционных). Если, наоборот, часть противоионов из двойного слоя не вытесняется или вытесняется с большим трудом, то следует полагать, что эти ионы удерживаются в мицелле силами, близкими по своей природе к химическим силам.
Высокая частота и высокое напряжение тока влияют на электропроводность гидрозолей аналогично тому, как они влияют на электропроводность обычных электролитов. Однако для коллоидных систем это влияние сказывается более резко, поскольку оно связано с электрофоретическим запаздыванием н электрической релаксацией, эффект которых проявляется особенно сильно у частиц коллоидных размеров.
Прн измерении электропроводности в поле высокой частоты колебания частиц настолько быстры, что полная асимметрия двойного слоя не успевает развиться. В результате этого эффект релаксации уменьшается, а электропроводность соответственно возрастает.
В поле очень высокого напряжения (105 В/см) скорость частиц настолько увеличивается, что они вырываются из окружающей их атмосферы ионов.
Следствием этого является исчезновение эффекта электрофоретического торможения в электрической релаксации.
Диэлектрическая проницаемость лиозолей. Диэлектрическая проницаемость лиозолей отличается от диэлектрической проницаемости дисперсионной среды. Это объясняется следующим.
1. Частицы золя имеют обычно другую и, как правило, меньшую диэлектрическую проницаемость, чем дисперсионная среда, в результате чего общая диэлектрическая проницаемость золя снижается. Этот эффект, очевидно, является простым объемным эффектом.
2. Частицы золя могут иметь постоянный дипольный момент. При определении диэлектрической проницаемости в электрическом поле диполи ориентируются, вследствие чего увеличивается поляризация и возрастает значение е. Этот эффект обычно незначителен у типичных коллоидных систем, частицы которых, как правило, не имеют постоянного дипольного момента. У растворов же высокомолекулярных соединений, молекулы которых могут обладать постоянным дипольным моменотм, этот эффект может приводить к значительному увеличению диэлектрической проницаемости
3. Частицы золя могут приобретать дипольные моменты, противоположно направленные внешнему электрическому полю вследствие деформации двойного электрического слоя в этом поле. Очевидно, при этом центры тяжести положительных и отрицательных зарядов частицы смещаются относительно друг друга, т. е. частицы поляризуются, что приводит к возрастанию диэлектрической проницаемости. Подобный эффект характерен для всех коллоидных систем и растворов высокомолекулярных электролитов.
4. Частицы золя могут гидратироваться или, в общем случае, сольватиро — ваться Молекулы среды в сольватном слое адсорбированы и ориентированы под действием значительных адсорбционных сил. Такая фиксация молекул среды приводит к уменьшению поляризации, а следовательно, и диэлектрической проницаемости системы
Из-за электропроводности лиозолей диэлектрическую проницаемость измерять необходимо с помощью переменного тока. Однако при этом надо помнить, что полученные значения зависят от частоты переменного тока. При не слишком больших частотах значение диэлектрической проницаемости не отличается существенно от тех значений, которые можно было бы найти в статическом поле, так как частицы успевают полиостью поляризоваться в промежуток времени меньший, чем продолжительность одного колебания поля. Однако при больших частотах последнее условие уже не выполняется, и в растворе обнаруживается дисперсия (рассеяние) диэлектрической проницаемости, характер которой зависит от того, какой фактор обусловливает ее особенности для дайной системы.
В первом случае, когда отклонение диэлектрической проницаемости обусловлено простым объемным эффектом, дисперсии этой величины не наблюдается Во втором случае дисперсия происходит при такой частоте, когда диполи уже не могут следовать за изменением направления поля. В третьем случае дисперсия наблюдается при частоте, уже не вызывающей асимметрии двойного слоя, т. е. при частоте, отвечающей увеличению электропроводности. Что касается того, влияет ли на дисперсию сольватация частиц, то этот вопрос до сих пор неясен. Имеющиеся экспериментальные данные об увеличении диэлектрической проницаемости растворов желатина и агара с возрастанием частоты можно объяснить ие только изменением гидратации макромолекул, но и действием ряда других факторов — влиянием частоты на двойной слой, иа поведение постоянных диполей и т. д.
 1 ноября, 2012
1 ноября, 2012  admin
admin  Опубликовано в рубрике
Опубликовано в рубрике 