Количество вещества А, молекулярно адсорбированное 1 г адсорбента из раствора, обычно вычисляют по уравнению:
A==jЈoHЈilZ_i000 (VI, 1)
Т
Где с0 и с і — начальная и равновесная концентрации адсорбтива, моль/л; V — объем раствора, из которого происходит адсорбция, л; т — масса адсорбента, г; 1000 — переводной множитель (для перевода измеряемой величины в ммоль/г).
Иногда, когда известна удельная поверхность адсорбента, величину адсорбции относят к единице поверхности (обычно к 1 см2).
Зависимость молекулярной равновесной адсорбции из раствора на твердом теле от концентрации адсорбтива характеризуется обычной изотермой адсорбции, и для достаточно разбавленных растворов в этом случае адсорбция хорошо описывается эмпирическим уравнением Фрейндлиха (IV, 2) или уравнением Ленгмюра i(IV, 10), Конечно, для описания адсорбции из раствора на твердом теле применимо и уравнение Гиббса, но, к сожалению, сложность определения поверхностного натяжения на границе твердое тело — раствор не позволяет непосредственно использовать его в этом случае.
Тем не менее величину гиббсовской адсорбции легко определить экспериментально, измеряя изменение мольной концентрации адсорбтива в растворе в результате адсорбции. Если общее число молей вещества в растворе равно п, а мольная доля адсорбтива до адсорбции составляла в растворе N0 и при равновесии с адсорбентом N, то
N(N„-N)
Т-8уд
Где т — масса адсорбента; syn — удельная поверхность адсорбента.
Влияние природы среды. Поскольку, как уже было указано, при адсорбции из раствора молекулы адсорбтива и среды являются конкурентами, очевидно, чем хуже адсорбируется среда на адсорбенте, тем лучше будет происходить адсорбция растворенного вещества. Исходя из того, что поверхностно-активные вещества обладают малым поверхностным натяжением, можно считать, что чем больше поверхностное натяжение самой среды, тем меньше ее молекулы способны к адсорбции на твердом теле и тем лучше на нем адсорбируется растворенное вещество. Именно поэтому адсорбция на твердом теле обычно хорошо идет из водных растворов и гораздо хуже из растворов в углеводородах, спиртах и других органических жидкостях со сравнительно малым поверхностным натяжением.
Другим критерием пригодности растворителя в качестве среды для адсорбции является теплота смачивания этим растворителем адсорбента. При введении адсорбента в жидкость выделяется теплота смачивания Q, равная разности полных поверхностных энергий адсорбента [8]:
Q-syAEi~E2) (V1.3)
Где £уД — удельная поверхность адсорбента; Et и Ег — полная поверхностндя энергия на границе адсорбент — воздух и адсорбент — жидкость соответственно.
Разность полярностей поверхностей на второй границе раздела всегда меньше, чем на первой, а поэтому Et > Ег и Q > 0. Теплота смачивания обычно колеблется в пределах 1—20 кал иа 1 г адсорбента и, понятно, зависит как от значений ЕІ и Ег, так и от пористости или дисперсности адсорбента.
Чем больше тепла выделяется при смачивании, тем интенсивнее энергетическое взаимодействие растворителя с адсорбентом и тем, следовательно, худшей средой для адсорбции является данная жидкость. В табл IV, 1 приведены
|
Значения теплот смачивания флоридина различными растворителями и количество бензойной кислоты, адсорбированной флоридином из этих растворителей, подтверждающие приведенное положение. Таблица VI, 1. Адсорбция на флоридине бензойной кислоты из 1%-ных растворов
Вещества, состоящие из полярных молекул, дают большой тепловой эффект при смачивании полярными жидкостями (например, водой); вещества, состоящие из неполярных молекул, выделяют больше тепла при смачивании неполярными жидкостями (например, углеводородами). Поскольку на теплоту смачивания сильно влияет значение удельной поверхности, П. А. Ребиндер предложил в качестве критерия взаимодействия полярной среды (воды) с адсорбентом величину а — отношение теплоты смачивания порошкообразного тела водой (Qi) и углеводородом (Qz): А = Q1/Q2 (VI,4) |
Диэлектрическая проницаемость до некоторой степени является мерой полярности вещества; следовательно, существует известная связь, с одной стороны, между диэлектрической проницаемостью жидкостей и с другой — адсорбционной способностью в этих жидкостях различных адсорбтивов.
В первом приближении можно также принять, что чем лучше среда растворяет адсорбтив, тем хуже идет в этой среде адсорбция. Это положение является одной из причин обращения правила Дюкло — Траубе. Так, когда адсорбция жирной кислоты происходит на гидрофильном адсорбенте (например, силикагеле) из углеводородной среды (например, из бензола), адсорбция с увеличением молекулярного веса кислоты не возрастает, как это следовало бы из правила Дюкло — Траубе, а уменьшается, так как высшие жирные кислоты лучше растворимы в неполярной среде.
Влияние свойств адсорбента и адсорбтива. На адсорбцию из растворов сильно влияют полярность и пористость адсорбента. Неполярные адсорбенты, как правило, лучше адсорбируют неполярные адсорбтивы, а цодярные-адсорбенты — полярные адсорбтивы.
Влияние пористости адсорбента зависит от соотношения размеров пор адсорбента и молекул адсорбтива. При увеличении пористости адсорбента адсорбция малых молекул адсорбтива из растворов обычно возрастает, так как мелкопористые адсорбенты, как правило, обладают большим избирательным действием и влияние химической природы поверхности у них повышено. Однако эта зависимость соблюдается лишь в том случае, когда молекулы адсорбтива достаточно малы и могут легко проникать в поры. Крупные молекулы адсорбтива не могут попасть в узкие поры адсорбента, и адсорбция уменьшается или, во всяком случае, чрезвычайно сильно замедляется. Результатом этого может явиться также обращение правила Дюкло — Траубе, т. е. с увеличением размера шэлекул адсорбтива адсорбция на адсорбентах с узкими порами не возрастает, а падает. В табл. VI, 2 приведены данные, характеризующие это положение, причем за характеристику адсорбционной способности взят коэффициент р из уравнения Фрейндлиха,
|
Таблица VI, 2. Адсорбция жирных кислот из водных растворов иа адсорбенте с узкими порами
|
Понятно, что на непористых, с гладкими поверхностями адсорбентах такого обращения правила Дюкло — Траубе наблюдаться не может. —і ~
Рассматривая (влияние химической природы; адсорбтива на его способность адсорбироваться на твердом теле, трудно сделаггь какие-нибудь обобщения, так как адсорбируемость одного и того же адсорбтива сильно зависит от полярности адсорбента и среды. Все же, определяя влияние на адсорбцию свойств самого адсорбтива, можно исходить из правила уравнивания полярности, сформулированного П. А. (Ребиндером. Согласно этому правилу вещество С может адсорбироваться на поверхности раздела фаз Л и В в то»м случае, если наличие вещества С в поверхностном слое приводит к уравниванию разности полярностей этих фаз. Иначе говоря, адсорбция будет идти, если значение полярности вещества С, характеризуемой, например диэлектрической проницаемостью е, лежит между значениями полярностей веществ А и В, т. е. если будет соблюдаться условие:
Ел>еС>8в ИЛИ 8Л<ес<ев
Из правила уравнивания полярностей также вытекает, что дем больше разцость полярностей между растворимым веществом и раствором, т_е,_чем меньше растворимость вещества, тем лучше оно будет адсорбироваться.
Из правила П. А. Ребиндера также следует, что дифильные молекулы поверхностно-активного вещества должны ориентироваться на границе раздела адсорбент — среда таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная часть — к неполярной. Воздух, если он является одной из фаз, можно считать неполярной фазой. Ориентацию молекул дифильных веществ, например, молекул жирной кислоты, на границе раздела между различными фазами поясняет схема, представлен* нля на рис. VI, 1.
Исходя из сказанного, можно сделать заключение, что все полярные гидрофильные поверхности должны хорошо адсорбировать поверхностно-активные вещества из неполярных или слабополярных жидкостей и, наоборот, неполярные гидрофобные поверхности
![]()
— Во3а — —^Ш в0з3ух
777771
Уголь Силикагель Вода
Рис. VI, 1. Схема ориентации дифильиых молекул на границе раздела фаз разиой природы.
Хорошо адсорбируют поверхностно-активные вещества издйполяр — ных жидкостей (например, из водных растворов). Именно на этом основано практическое применение полярных адсорбентов (силикагель, глины, флоридин) для адсорбции поверхностно-активных веществ из неполярных сред и неполярных адсорбентов (уголь) для адсорбции из полярных сред.
Помимо общих положений о влиянии природы адсорбтива на адсорбцию имеется и ряд частных правил. Так, с увеличением молекулярного веса способность вещества адсорбироваться возрастает. Именно поэтому алкалоиды, а также красители, обладающие обычно высокими молекулярными весами, хорошо адсорбируются. Замечено также, что ароматические соединения вообще адсорбируются лучше, чем алифатические, а непредельные соединения лучше, чем насыщенные. Наконец, так же как и при адсорбции на границе раствор — воздух, при адсорбции жирных кислот и спиртов на твердых веществах качественно соблюдается известное правило Траубе.
Влияние времени, температуры и концентрации раствора. Адсорбция вещества из раствора идет медленнее адсорбции газа, так как уменьшение концентрации в граничном слое может восполняться только путем диффузии, происходящей в жидкости в общем довольно медленно. Для ускорения установления адсорбционного равновесия при этом часто применяют перемешивание системы.
Особенно медленно происходит адсорбция больших молекул на адсорбенте с достаточно узкими капиллярами. В этих условиях.
Как мы уже указывали, равновесие устанавливается чрезвычайно медленно или вовсе не наступает. В табл. VI, 3 приведены данные,
|
Таблица VI, 3. Зависимость времени, необходимого для установления адсорбционного равновесия, от размера молекул жирных кислот и размера пор угля
|
Характеризующие скорость адсорбции двух жирных кислот различного молекулярного веса на сахарном угле, имеющем поры различного диаметра. Как можно видеть, с увеличением молекулярного веса кислоты время наступления адсорбционного равновесия сильно возрастает.
Пріі_ліошшенші температуры адсорбция из раствора уменьшается, однако обычно в меньшей степени, чем адсорбция газов.
Однако, когда растворимость малорастворимого адсорбтива в растворителе с увеличением температурь; повышается, адсорбция также может возрастать вследствие достижения значительно более высоких концентраций равновесного раствора. Такое явление наблюдается, например, при адсорбции нафталина на гидроксилированной поверхности кремнезема из раствора в н-геп — тане.
|
Рис. VI, 2. Зависимость Г от. мольной доли N адсорбтива: 1 — сильная адсорбция адсорбтива if слабая адсорбция растворителя; 2—слабая адсорбция адсорбтива и Сильная адсорбция растворителя; Л— слабая адсорбция компонентов. |
На рис. VI, 2 схематически показано изменение величины гиббсовской адсорбции Г в зависимости от мольной доли N адсорбтива в равновесном растворе. При сильной адсорбции адсорбтива и слабой адсорбции растворителя кривая 1 вначале круто поднимается вверх, проходит через максимум и затем падает до нуля почти прямолинейно. Снижение величины адсорбции Г объясняется тем, что при больших значениях N концентрации адсорбтива в поверхностном слое и в объеме раствора становятся очень большими и притом одинаковыми. Изотерма 2 характеризует отрицательную адсорбцию, абсолютное значение которой возрастает
сначала линейно, потом достигает максимума и, наконец, при очень высокой концентрации адсорбтива в поверхностном слое и в объеме падает до нуля. Изотерма 3 характеризует сначала положительную гиббсовскую адсорбцию, которая затем меняет знак, переходя через нуль, и становится отрицательной. Отрицательная адсорбция с увеличением N также достигает нуля. В точке пересечения изотермы с осью абсцисс концентрации поверхностного и объемного растворов одинаковы, так что данный адсорбент не может разделить смеси. Это явление называют адсорбционной аэеотропией.
Следует заметить, что адсорбция из раствора определяется не полным значением потенциальной энергии системы молекула адсорбтива — адсорбент, как это имеет место при адсорбции газа при малом давлении, а разностью потенциальных энергий молекулы адсорбтива по отношению к адсорбенту и по отношению к растворителю. Поэтому теплота адсорбции адсорбтива из раствора обычно в несколько раз меньше его адсорбции на том же адсорбенте из газовой фазы.
В заключение отметим, что адсорбцря жирных кислот и ряда других поверхностно-активных веществ из их растворов в неполярных жидкостях может приводить к формированию на поверхности твердых тел граничных полимолекулярных слоев толщиною 0,05—0,5 мкм. Как показали Б. В Дерягин с сотр. и Г И Фукс с сотр.. механические свойстве таких слоев отличаются от свойств объемных слоев раствора и зависят от структуры и молекулярного веса молекул поверхностно-активного вещества Было также показано, что толщина граничного слоя растворов жирных кислот ь гексане или бензоле является линейной функцией длины углеводородного радикала, а температура «плавления» этого слоя (снижение механических свойств до значения свойств объема раствора) зависит от температуры плавлення соответствующих поверхностно-актив — ных веществ Граничные слои обеспечивают устойчивость дисперсных систем в неполярных жидкостях и играют важную роль в действии смазочных масел.
Значение адсорбции из растворов в природе и технике. Адсорбция из растворов имеет огромное значение для большинства физико-химических процессов, происходящих в растительных и животных организмах. Явления химических превращений при усвоении питательных веществ обычно начинаются с накопления реагирующих веществ на поверхности природных катализаторов — ферментов. Проникновение беществ в организм через полупроницаемые перегородки также обычно начинается с явлёния адсорбции, происходящего на поверхности раздела.
В технике молекулярная адсорбция из растворов получила очень широкое применение. Т. Е. Ловиц впервые применил адсорбцию еще в XVIII в. для очистки древесным углем растворов от различных примесей. В настоящее время обычный способ осветления сахарных сиропов осуществляется обработкой их активным углем. Смазочные масла также очищают с помощью специальных пин, действующих в качестве адсорбента.
Путем адсорбции извлекают малые количества веществ, растворенных в больших объемах жидкости. Этим, например, пользуются в технологии редких элементов.
Очень широко адсорбцию применяют в аналитической химии для разделения трудно разделяемых соединений. На процессах адсорбции основана хроматография, впервые предложенная в 1903 г. русским ученым М. С. Цветом. Этим методом М. С. Цвет смог разделить сложный растительный пигмент хлорофилл на составные части.
Метод адсорбционной хроматографии в простейшем его виде заключается в том, что через трубку (адсорбционную колонку), наполненную каким-нибудь адсорбентом (А1203, MgO, СаО, СаС03, фуллерова земля, флоридин)’, в течение длительного времени медленно пропускают раствор смеси веществ, которые необходимо разделить. При этом на адсорбенте в верхней части трубки отлагаются сильно адсорбирующиеся компоненты смеси, менее сильно адсорбирующиеся компоненты отлагаются в средних частях трубки и наименее адсорбирующиеся компоненты отлагаются на адсорбенте в самом низу трубки. Мало адсорбируемые вещества не могут задерживаться в верхних слоях адсорбента, так как при прохождении через эту зону новых порций раствора вещества, обладающие высокой адсорбционной способностью, вытесняют с поверхности адсорбента менее адсорбционноспособные соединения.
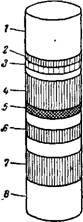
В результате по длине столба адсорбента образуются зоны, насыщенные отдельными компонентами смеси. Если отдельные компоненты имеют различную окраску, то эти зоны легко отличить по цвету. Если же компоненты бесцветны, но способны к люминесценции, то для определения границ между этими зонами слой адсорбента исследуют в ультрафиолетовом свете.
|
|
|
Рис. VI, 3. Хроматограмма хлорофилла: 1—бесцветный слой; 2—ксантофилл Р (желтый), 3 — хлорофнллнн р (желто-зеленый), 4 — хлорофнллнн а (зелено-синий), 5—ксантофилл (желтый), «—ксантофилл а’ (желтый), 7—ксантофилл а (желтый), 8•—хлорофиллии (серо-стальной). |
Для выделения отдельных компонентов столбик адсорбента осторожно выдавливают ч из трубки и разделяют на ряд коротких столбиков (зон), из которых затем можно извлечь адсорбированный компонент подходящим растворителем.
На рис. VI, 3 показана хроматограмма хлорофилла, состоящего, как известно, из нескольких близких по строению, но различно окрашенных веществ, что не позволяет их разделить химическими методами, но дает возможность различить их по окраске, применяя метод хроматографии.
Для увеличения резкости границы между отдельными зонами, в которых адсорбировано то или иное вещество, приходится обычно прибегать к дополнительному «проявлению» хроматограммы. Для этого через колонку пропускают сравнительно небольшой объем исследуемой смеси, растворенной в подходящем растворителе. После этого через колонку пропускают чистый растворитель (или
последовательно ряд растворителей) и исследуют состав выходящего раствора, в котором компоненты появляются один за другим по мере увеличения их способности адсорбироваться адсорбентом. Этот метод называется проявительным. На рис. VI, 4 приведена типичная дифференциальная хроматограмма, полученная при разделении смеси аминокислот на колонке с крахмалом. Как можно видеть, почти каждый компонент дает на кривой самостоятельный пик и может быть собран в отдельную фракцию.
Вместо растворителя через колонку можно пропускать раствор какого-нибудь вещества, которое адсорбируется сильнее, чем любой из компонентов исследуемой смеси. В этом случае хроматограмма имеет также ряд пиков, расположенных в порядке возрастания адсорбируемости веществ, и заканчивается
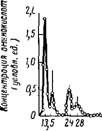
|
,1 Лейцин+ — тзопейциН |

|
Алании* *гттапина6ая Кислота |
|
CeJ>u" Аммиак киспото І Глицин |
|
Гистидин Цистин |
|
75 82 100 106 777 135 Объем бытекшей жидкости, мл |
|
Фенилопонин Волин Пронин /Іетионин Тирозин |
Рнс. VI, 4. Элюционное разделение аминокислот на крахмальной колонке (по
Штейну и Муру):
Растворители: к-бутаиол, к-пропаиол, 0,1 и. НС1 (1 :2 : 1) и, после аспарагииовоВ кислоты,
К-пропанол, 0,5 и. НС1 (2 : 1).
Выходом чистого вытесняющего вещества. Этот метод хроматографии называется вытеснительным.
Мы кратко остановились на некоторых методах жидкостной хроматографии. Но существует еще много других методов хроматографии — осадочная, газовая, газо-жидкостная и т. д. Все эти методы подробно рассматриваются в специальных разделах аналитической химии.
Для хроматографии первичный акт адсорбции может иметь в зависимости от адсорбента и разделяемых веществ характер молекулярной адсорбции или ионного обмена. Первичные процессы молекулярной адсорбции при хроматографии подчиняются уравнениям Ленгмюра или Фрейдлиха, а первичные процессы при ионном обмене — уравнению Б. П. Никольского, о котором будет сказано ниже.
Хроматография получила очень широкое применение при разделении и очистке лекарственных веществ, витаминов, пигментов, энзимов, протеинов и алкалоидов.
Интересно, что хроматография сыграла очень большую роль при открытии новых, искусственно приготовленных трансурановых элементов. Именно с помощью этого метода были разделены элементы № 99 эйнштейний (Es), № 100 фермий (Fm) и № 101 менделевий (Md).
 1 ноября, 2012
1 ноября, 2012  admin
admin 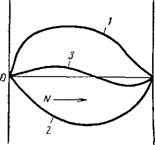
 Опубликовано в рубрике
Опубликовано в рубрике 